Water is de meest belangrijke stof die er op de aarde te vinden is. Zonder water was er geen leven mogelijk geweest. Het mensenlijke lichaam bestaat zelfs voor 70% uit water.
Water is er in vele verschijningsvormen. Cola bestaat voor 99% uit gewoon water, maar (natuur)ijs ook. Wolken in de lucht bestaan ook vrijwel volledig uit water. Waterdamp is onzichtbaar, maar het is ook gewoon water. Hieronder volgt een uitleg over wat water nu precies is.
Het watermolecuul
Alle stoffen op aarde zijn opgebouwd uit moleculen. Zo is er ook een watermolecuul. Moleculen zijn op hun beurt weer opgebouwd uit atomen. Het watermolecuul is opgebouwd uit drie atomen, namelijk één zuurstofatoom en twee waterstofatomen. Ter vergelijking: zuurstof, de stof die we allemaal nodig hebben om in te ademen, is opgebouwd uit twee zuurstofatomen. Het symbool voor water in de scheikunde is H2O, waar de H2 staat voor twee waterstofatomen, en de O voor het zuurstofatoom.
Alle verschijningsvormen van water zijn uit datzelfde watermolecuul opgebouwd. In principe zijn er van alle stoffen drie verschijningsvormen: vast, vloeibaar, en gas. Dit geldt ook voor water, alleen kennen we de drie vormen daar onder andere, vertrouwde namen: ijs, water en waterdamp. De verschijningsvorm van water hangt af van de temperatuur van het water. Bij kamertemperatuur (20C) is water vloeibaar. Onder nul graden (het vriespunt) verandert het vloeibare water in ijs. Boven de 100 graden gaat het koken: het verdampt tot waterdamp.
Het verschil wordt veroorzaakt door de manier waarop de moleculen geordend zijn. Bij ijs zitten ze in een vast raster tegen elkaar geklemd. Bij water zitten ze wat losser op elkaar en bij waterdamp stuiteren ze volledig losgeslagen alle kanten op. Omdat bij waterdamp de moleculen volledig los van elkaar zijn, kunnen we het niet meer zien. Een individuele molecuul is veel te klein om waar te nemen.
Raar ijs
Water is eigenlijk een heel merkwaardige stof. Van alle stoffen bekend in de natuurkunde is de vaste vorm zwaarder dan de vloeibare. Dit is ook logisch: de moleculen zitten tenslotte dichter op elkaar. Bij water is het precies andersom en dat is maar goed ook: als het ijs zou zinken zou schaatsen onmogelijk zijn.
Dit komt omdat water, in tegenstelling tot alle andere stoffen, uitzet als het bevriest. Behalve dat we hierdoor kunnen schaatsen, heeft het nog meer gevolgen. Er komen enorm veel krachten vrij bij het uitzettende ijs. Dat laat zich door niets tegenhouden. Zo kunnen ingevroren schepen kapot worden gedrukt door het uitzettende ijs. Ook kunnen dijken door de ijslaag op zee weggedrukt worden.
Verder kennen wij in water nog enkele andere eigenschappen die met name voor ons, als aquariumhouders, van belang zijn:
De zuurgraad (pH)
De zuurgraad wordt uitgedrukt in een getal: de pH waarden (pondus hydrogenii ofwel het gewicht van de waterstofionen in het water), die kan variëren van 1 tot 14. water met een PH van 7.0 noemen wij neutraal daar deze noch zuur als basisch is. Waarden onder de 7.0 wordt aangeduid als zuur en waarden boven de 7.0 als basisch. De meeste organismen kunnen bij een extreem lage of hoge PH niet leven. Voor de gezelschapsbak ook wel Hollandse bak genoemd liggen de waarden van de PH tussen de 6.8 en de 7.5. Bij Tangayika en Malawi ligt dit aanzienlijk hoger vanaf 7.5 tot aan 8.5. In de aquariumwinkel zijn goede vloeistof testen te koop van de merken als Dupla, Sera en Tetra; deze geven een goede weergave.
De tijdelijke hardheid (KH)
Deze bestaat uit verbindingen van calcium en magnesium met koolzuur. Deze verbinding noemen wij carbonaten deze lossen moeilijk op maar verbonden met koolzuur vormen deze weer bicarbonaten en deze lossen wel makkelijk op. De KH heeft hierdoor een bufferend vermogen. Koolzuur ook wel CO2 genoemd heeft een zuurmakend vermogen indien het vrij in het water is zolang de carbonaten het nog aan zich binden zal de PH niet dalen. Wanneer wij voldoende koolzuur toevoegen raken de carbonaten opgelost en blijft er vrije koolzuur over welke het water zuur maakt. Andersom kan ook, de vrije koolzuur is verbruikt door de assimilatie van de planten en deze hebben het vermogen (vooral waterpest, Valisneria en hoornblad) om de CO2 die gebonden zit als aan het carbonaat op te nemen. Gevolg is dat de PH stijgt, nu ligt biogene ontkalking op de loer. In het basis waterchemie van de vereniging gaan wij hier dieper en verder op in. De pH, KH en CO2 zijn elementen die aan elkaar zijn gebonden, verandert er één dan veranderen de andere twee mee.
De permanente hardheid (GH)
Deze bestaat uit de calcium en magnesiumzouten. De totale hardheid is de KH en GH bij elkaar op geteld. DH1 staat voor 10 milligram calciumoxide per liter water. Een DH van 8 geeft dus aan dat er 80 milligram calciumoxide per liter water in het water aanwezig is. Deze hardheden worden geregeld door elkaar heen gehaald.
Het elektrisch geleidingsvermogen
Het elektrisch geleidingsvermogen (in µS/cm), ook wel microSiemens genoemd, wordt bepaald door de hoeveelheid opgeloste stoffen in het water. In water uit een omkeerosmose installatie, waaruit bijna alle stoffen verwijderd zijn, zal het geleidingsvermogen ca 30 – 70 µS/cm zijn. Gedestilleerd water heeft een geleidingsvermogen van bijna 0 µS/cm. Het geleidingsvermogen zegt niets over welke stoffen er in het water aanwezig zijn, het geeft slechts een indruk van de totale hoeveelheid aanwezige stoffen. Het optimale geleidingsvermogen voor een beplant aquarium of vijver is een waarde tussen 300 en 600 µS/cm. Bij te lage waarden komt de aanvoer van voldoende mineralen als voedingsstoffen voor planten in het gedrang. Bij te hoge waarden loopt de osmotische druk te sterk op, waardoor planten water verliezen.
Redoxpotentiaal (rH-waarde)
Dit is de verhouding tussen reducerende (red-) en oxiderende (-ox) stoffen. De reducerende stoffen zijn o.a. afvalstoffen, zoals de uitwerpselen van vissen. Oxiderende stoffen zijn bijvoorbeeld zuurstof en ozon, die op hun beurt afvalstoffen verwerken (verbranden). In een goed functionerend filter zijn voldoende oxiderende stoffen aanwezig om tot een goede afbraak van de afvalstoffen te kunnen komen, bijvoorbeeld door middel van zuurstof. De afbraakprocessen verlagen echter ook de pH-waarde. Door rH-metingen kan men inzicht krijgen in het afbraakproces. Diverse meststoffen die door planten worden opgenomen, bv. half- en sporenelementen, werken ook reducerend op het aquariummilieu. Die worden bij te grote hoeveelheden oxiderende stoffen verbrand. Het is dus zaak een goede balans te krijgen tussen oxiderende en reducerende stoffen. De miniVolt(mV)metingen, die met diverse elektronische meters worden gedaan zeggen iets over de verhouding tussen oxiderende en reducerende stoffen. Echter, de pH-waarde zelf vormt ook een onderdeel van deze verhouding. Wil men deze rekenkundig mee verwerken, dan rekent men de mV-waarde om in het rH-getal. Hierin zit de pH-waarde dan verrekend. Voor de exacte berekening kan men de bijgeleverde handleiding van het meetapparaat raadplegen. De omrekening is namelijk per apparaat verschillend en hangt in grote mate af van de bijgeleverde elektrode en de daarmee samenhangende celconstante van de elektrode.
Calciumgehalte
Het calciumgehalte (ook wel kalkgehalte) is een zeer belangrijke factor in de opbouw van waterchemie. In de eerste plaats, omdat calcium een deel van de GH-waarde vormt en in de tweede plaats nodig is voor de groei van planten in aquaria en vijvers. In zeewateraquaria is het calcium bovendien een belangrijke factor voor de skeletopbouw van de lagere dieren. In zeewater kan men het verbruikte calcium het beste regelmatig met Calciumplus aanvullen. Dit is een poeder om van leidingwater kalkwater te maken in een afgesloten jerrycan. Als het poeder is bezonken en grotendeels is opgelost, gebruikt men de ontstane oplossing voor het bijvullen van het verdampte water. In vijvers kan gebruik gemaakt worden van Biocell P. Dit middel zorgt voor een verhoging van het calcium- en magnesiumgehalte, waardoor tekorten in de mineraalbalans worden opgeheven.
Stikstofkringloop
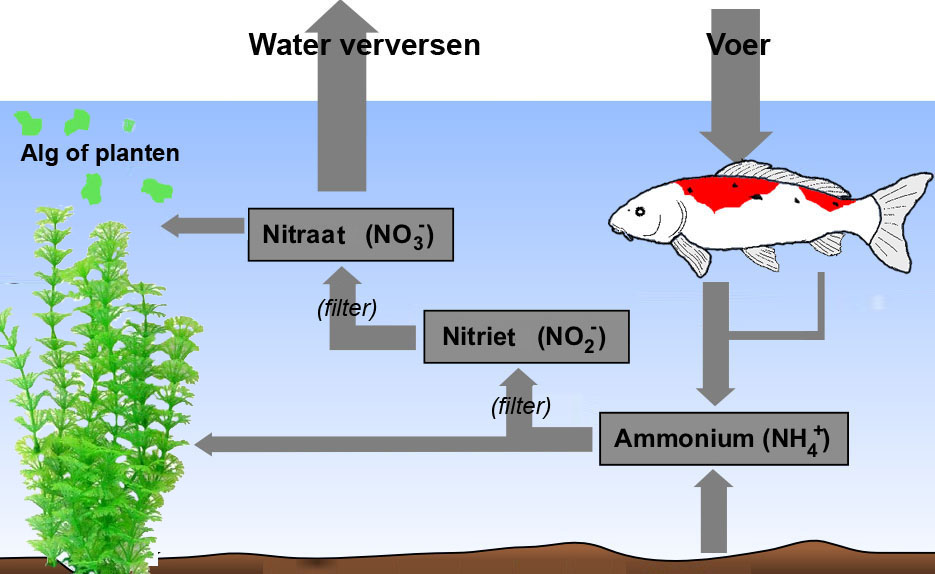
Ammonium is het eerste tussenproduct dat door bacteriën wordt gemaakt uit stikstofhoudende afval. Na een filterreiniging kan snel een ammoniumverhoging ontstaan door het gebrek aan bacteriën. Bacteriën gaan namelijk met het verwisselen van filtermaterialen verloren. Bij hoge pH-waarden wordt het ongevaarlijke ammonium omgezet in het zeer giftig ammoniak. Dat is dan ook de reden dat in zeewateraquaria het ammonium/ammoniakgehalte veel lager gehouden dient te worden. UV-lampen breken ammoniak af tot nitriet.
Nitriet is een zeer giftig tussenproduct uit de stikstofkringloop. Zelfs bacteriën sterven hierdoor als concentraties boven 1,5 mg/l ontstaan. Voor vissen kan een nitrietgehalte boven 1,5 mg/l al giftig en zelfs dodelijk zijn. Planten kunnen dit tussenproduct niet verwerken. Men dient dus regelmatig het nitrietgehalte te meten. Vooral in pas opgestarte vijvers of aquaria is dit uitermate belangrijk. Het nitrietgehalte kan men verlagen door een gedeeltelijke waterwisseling, ofwel het toedienen van aerobe bacteriën in combinatie met een goede beluchting.
Nitraat is het eindproduct uit de stikstofkringloop. Het is het laatste product uit de aerobe kringloop van de afbraak van afvalstoffen tot voedingsstoffen voor de planten. Nitraat kan in geringe hoeveelheden door planten als voedingsstof worden opgenomen, mits er een toereikende hoeveelheid ijzer en sporenelementen in het aquarium aanwezig is. Een teveel aan nitraat kan schadelijke gevolgen hebben. Dit uit zich onder andere in een toegenomen algengroei. Een dalend nitraatgehalte laat een afneming van de groei van plantaardige organismen in het aquarium of de vijver zien. Als al het nitraat verwerkt is, stopt de totale plantengroei in het aquarium of de vijver. In een goed functionerend aquarium moet er daarom ook altijd een beetje nitraat aanwezig zijn. Een aquarium in de juiste biologische balans heeft een nitraatgehalte, dat juist hoog genoeg is om de planten van voldoende voeding te voorzien en om algen net niet genoeg voeding te ‘geven’. Planten hebben namelijk veel efficiëntere methoden voor de voedselopname, zodat ze met veel lagere concentraties voedingsstoffen kunnen blijven groeien.
Bron: www.aponogeton.nl/